
हमारा राष्ट्र ध्वज
यह तीन रंग की समान चौड़ाई की आयताकार पट्टियों से बना है। सबसे ऊपरी पट्टी केसरिया बीच में श्वेत पट्टी और निचली पट्टी हरे रंग की होती है।
बीच के श्वेत पट्टी के केंद्र में गहरे नीले रंग का अशोक चक्र बना है।इसमें समान दूरी पर स्थित 24 तीलियाँ बनी होती हैं।
पूरा ध्वज आयताकार होता है,जिसमें लंबाई और चौड़ाई का अनुपात 3:2 होता है।
संविधान सभा में राष्ट्रध्वज के बारे में डॉक्टर राधाकृष्णन ने बताया कि भगवा या केसरिया रंग “त्याग और निस्वार्थता” का प्रतीक है। श्वेत रंग “प्रकाश और सत्य के पथ” का प्रतीक है और हरा रंग “धरती और पेड़-पौधे के साथ हमारे संबंध” को व्यक्त करता है।
अशोक चक्र धर्म के नियम का चक्र है।यह चक्र गति का भी प्रतीक है। गति में जीवन है,भारत को गतिमान रहना और आगे बढ़ाना है।
ध्वज की मर्यादा और सम्मान के अनुकूल जो भारतीय राष्ट्रीय ध्वज संहिता में विस्तार से लिखा हुआ है, कोई भी राष्ट्रीय ध्वज सभी दिन, समारोह या अन्य अवसरों पर फहरा सकता है।
जहां किसी सार्वजनिक भवन पर ध्वज फहराने का चलन है,इसे रविवार और छुट्टियों के दिन भी फहराया जाता है। उसे भवन पर किसी अत्यंत विशिष्ट अवसर पर रात में भी ध्वज फहराया रखा जा सकता है।
राजकीय/ सैनिक/ अर्ध-सैनिक अंतिम संस्कारों के अतिरिक्त किसी भी अवसर पर राष्ट्रीय ध्वज को कुछ लपेटने के कार्य में प्रयुक्त नहीं किया जा सकता है। उन अवसरों पर भी ध्वज को चिता या कब्र में नहीं डाला जाता।
यदि ध्वज फट गया हो तो इसे जैसे-तैसे फेक नहीं दिया जाता बल्कि सम्मान पूर्वक एकांत में प्राय: जलाकर नष्ट किया जाता है।
राष्ट्रध्वज को पोशाक या पहनावे के रूप में प्रयोग किया जा सकता है किंतु कमर के नीचे या अधोवस्त्र के रूप में इसका प्रयोग नहीं किया जा सकता है।
ध्वज के ऊपर किसी भी तरह का कुछ लिखना मना है। इसे किसी तरह के विज्ञापन के लिए भी प्रयोग नहीं किया जा सकता है।
राष्ट्रध्वज को एक ही स्तंभ पर दूसरे ध्वज के साथ नहीं फहराया जा सकता है।
जब कोई विदेशी महानुभाव सरकार द्वारा प्रदत्त कार में चलते हैं, तो कार में आगे दाहिनी ओर अपने देश का राष्ट्रध्वज रहता है और अन्य देश का राष्ट्रध्वज बाई ओर रहता है।
देश के राष्ट्रपति,उपराष्ट्रपति और प्रधानमंत्री का निधन होने पर पूरे देश में राष्ट्रध्वज आधा झुका दिया जाता है।
राष्ट्रीय ध्वज का निरादर करना दंडनीय अपराध है।
हमें अपने राष्ट्रध्वज को प्रणाम करना और उससे प्रेम रखना चाहिए।
विज्ञान किसे कहते हैं?
हमारे आसपास जो कुछ भी घटित हो रहा है,उसका व्यवस्थित ज्ञान ही विज्ञान (वि +ज्ञान) कहलाता है।
वि का अर्थ है – क्रम या विशेष
विज्ञान शब्द की उत्पत्ति लैटिन शब्द “SCIENTIA” से हुई है जिसका अर्थ है ज्ञान।
विज्ञान तथ्यों, सिद्धांतों और नियमों पर आधारित होता है।
हमारे जीवन में विज्ञान के फायदे और नुकसान दोनों मौजूद हैं।
विज्ञान की दो मुख्य शाखाएं हैं: –
प्राकृतिक विज्ञान (Natural Science)- इसके दो मुख्य भाग हैं- वनस्पति विज्ञान(Botany) और जंतु विज्ञान(Zoology)
भौतिकीय विज्ञान (Physical Science)
इसके दोमुख्य भाग हैं- भौतिक विज्ञान(Physics) तथा रसायन विज्ञान (Chemistry)
NCERT क्या है?
इसका हिंदी में पूरा नाम राष्ट्रीय शैक्षिक अनुसंधान एवं प्रशिक्षण परिषद है।
इसका अंग्रेजी में पूरा नाम National Council of Educational Reasearch and Training हैं।
कार्य:- स्कूली शिक्षा से जुड़े शोध करना,उसे बढ़ावा देना और समन्वय करना।शिक्षा पद्धति में बदलाव और विकास को लागू करना।
इसका मुख्यालय नई दिल्ली स्थित है।
इसकी स्थापना वर्ष 1961 में की गई थी।
वर्तमान में इसके अध्यक्ष “दिनेश प्रसाद सकलानी” है।
NCF क्या है?
इसका हिंदी में पूरा नाम राष्ट्रीय पाठ्यचर्या की रूपरेखा है।
इसका अंग्रेजी में पूरा नाम National Curriculum Framework हैं।
यह एक दस्तावेज है, जो भारत में शिक्षा की नीति और उद्देश्यों को तय करता है।(प्री स्कूल से 12वीं तक, 3 से 18 साल तक को कवर)
लक्ष्य :- बदलती दुनिया में कामयाब होने के लिए जरूरी कौशल और ज्ञान से लैस व्यक्तियों का विकास करना।
यह पाठ्यक्रम, पाठ्यपुस्तक, शिक्षण पद्धतियों को बनाने के लिए व्यापक दिशानिर्देश देता है।
NCF 2023,NEP 2020 का अहम हिस्सा है।
NEP क्या है?
इसका हिंदी में पूरा नाम राष्ट्रीय शिक्षा नीति है।
इसका अंग्रेजी में पूरा नाम National Education Policy है।
यह भारत सरकार की एक नीति है, जिसका मकसद देश की शिक्षा प्रणाली में सुधार करना है। NEP 2020 को केंद्रीय मंत्रिमंडल द्वारा 29 जुलाई 2020 को मंजूर किया गया।
यह नीति NEP 1986 की जगह लेती है।
इस नीति के तहत शिक्षा को छात्र केंद्रित बनाने, रटने की प्रणाली खत्म करने और कौशल विकास पर जोर देने का प्रावधान है।
भारत के संविधान की उद्देशिका क्या हैं?
यह संविधान का सार है।
इसी संविधान की आत्मा और रीढ़ भी कहा जाता है।
यह प्रस्तावना के खंड संविधान को सही तरीके से लागू करने का निर्देश देते हैं।
संविधान सभा ने से 26 नवंबर 1949 को अपनाया था।
26 जनवरी 1950 को इसे लागू किया गया, जिसे भारत के गणतंत्र दिवस (Republic day) के रूप में मनाया जाता है।
26 जनवरी 1950 को देश के पहले राष्ट्रपति डॉ राजेंद्र प्रसाद ने भारत को पूर्ण गणतंत्र घोषित किया था।
NEW SYLLABUS
| CHAPTER-1 हमारे आसपास के पदार्थ | |
| CHAPTER-2 क्या हमारे आसपास के पदार्थ शुद्ध हैं? | |
| CHAPTER-3 परमाणु एवं अणु | |
| CHAPTER-4 परमाणु की संरचना | |
| CHAPTER-5 जीवन की मौलिक इकाई | |
| CHAPTER-6 ऊतक | |
| CHAPTER-7 गति | |
| CHAPTER-8 बल तथा गति के नियम | |
| CHAPTER-9 गुरुत्वाकर्षण | |
| CHAPTER-10 कार्य तथा ऊर्जा | |
| CHAPTER-11 ध्वनि | |
| CHAPTER-12 खाद्य संसाधनों में सुधार |
CHAPTER- हमारे आसपास के पदार्थ

INTRODUCTION
Chemistry की परिभाषा क्या होता है?
रसायन विज्ञान, पदार्थों के गुणों, संरचना, और उनमें होने वाले बदलावों का अध्ययन करने वाला विज्ञान है।
Chemistry के Father कौन है?
Antoine Lavoisier (एंटोनी लावोइसियर)- (1743-1794) को रसायन विज्ञान का जनक कहा जाता है।यह एक फ़्रांसीसी थे।
द्रव्य या पदार्थ वह वस्तु है, जो स्थान घेरता है तथा जिसमें द्रव्यमान होता है।
द्रव्य और द्रव में अंतर क्या होता है?
वह वस्तु जो स्थान घेरता है तथा जिसमें द्रव्यमान होता है उसे द्रव्य कहते हैं। द्रव, द्रव्य का रूप होता हैं।
प्राचीन भारतीय एवं यूनानी दार्शनिकों का विचार था कि पदार्थ पांच मूल तत्वों से बनता है। उन्होंने इन मूल तत्वों को पंचतत्व कहा। यह पंचतत्व है:- वायु, पृथ्वी, अग्नि,जल और प्रकाश। इन्हीं पंचतत्वों से सभी वस्तुएं बनी हो बनी है,चाहे वह संजीव हो या निर्जीव।
दार्शनिकों कौन होते हैं?
जो व्यक्ति ज्ञान या आत्मज्ञान चाहता है, विचारशील होता है, और मुसीबतों का सामना करते समय शांत रहता है,उसे दार्शनिक कहते हैं। दार्शनिक को अंग्रेज़ी में फ़िलॉसिफ़र (Philosopher) कहते हैं।दार्शनिक, अक्सर पारंपरिक विचारों को चुनौती देते हैं।दार्शनिक शब्द की उत्पत्ति प्राचीन ग्रीक के शब्द ‘फ़िलोसोफ़ोस’ से हुई है, जिसका मतलब है ‘ज्ञान का प्रेमी’।
आधुनिक वैज्ञानिकों ने पदार्थ को निम्न दो आधारों पर वर्गीकृत किया है:-
1-भौतिक गुणधर्मों के आधार पर
2-रासायनिक गुणधर्मों के आधार पर
भौतिक अवस्था के आधार पर पदार्थ का वर्गीकरण: –
1-ठोस
2-द्रव
3-गैस
रासायनिक संगठन के आधार पर पदार्थ का वर्गीकरण:-
1-शुद्ध द्रव- इसके दो भाग हैं।
(A)- तत्व (B)- यौगिक
2-मिश्रण- इसके दो भाग हैं
(A)- समांगी (B)- विषमांगी
मापन क्या होता है?
किसी पदार्थ का उसके मात्रक से तुलना करना ही मापन कहलाता है।
मात्रक क्या होता है?
किसी वस्तु के मापन के लिए हम उस वस्तु के एक निश्चित मात्रा को आधार बना लेते हैं,उसको ही वस्तु का मात्रक कहा जाता है।
मूल राशियां और व्युत्पन्न राशियां क्या होती हैं?
वह राशि जो किसी अन्य राशि पर निर्भर नहीं करती उसे मूल राशि कहते हैं। इसकी संख्या 7 हैं।
1-लंबाई (मीटर)
2-द्रव्यमान (किलोग्राम)
3-समय (सेकेंड)
4-तापमान (केल्विन)
5-विद्युत ऊर्जा (एम्पीयर)
6-ज्योति तीव्रता (कैंडेला)
7-पदार्थ की मात्रा (मोल)
वह राशि जो मूल राशि के सहयोग से बनाई जाती हैं, उन्हें व्युत्पन्न राशि कहा जाता है। जैसे:- बल, त्वरण इत्यादि।
मूल मात्रक और व्युत्पन्न मात्रक क्या होते हैं?
मूल राशियों के मात्रक को मूल मात्रक कहा जाता है।व्युत्पन्न राशियों के मात्रक को व्युत्पन्न मात्रक कहा जाता है।
मापन की कितनी पद्धतियां हैं?
1-CGS पद्धति
2-MKS पद्धति
3-FPS पद्धति
4-S.I पद्धति
क्षेत्रफल तथा आयतन में क्या अंतर है?
क्षेत्रफल का मतलब है किसी आकृति या सतह के आकार का माप।आयतन का मतलब है,कोई वस्तु या बंद सतह कितनी जगह घेरती है। आयतन को क्षमता भी कहा जाता है।आयतन मापने का साधारण मात्रक लीटर होता है।
TOPIC N0.1-पदार्थ का भौतिक स्वरूप
पदार्थ कणों से मिलकर बना होता है:- जब हम जल में नमक घोलते हैं तो नमक के कण जल के कणों के बीच के रिक्त स्थान में समावेशित हो जाते हैं।अतः हम यह कह सकते हैं कि सभी पदार्थ कणों से मिलकर बने होते हैं।पदार्थ के कण बहुत छोटे होते हैं, इतने छोटे कि हम कल्पना भी नहीं कर सकते।
TOPIC N0.2-पदार्थ के कणों के अभिलाक्षणिक गुण
1-एक पदार्थ के कण दूसरे पदार्थ के कणों के रिक्त स्थान में समावेशित हो जाते हैं। यह दर्शाता है कि पदार्थ के कणों के बीच रिक्त स्थान होता है।
2-पदार्थ के कारण निरंतर गतिशील होते हैं। उनमें गतिज ऊर्जा होती है। तापमान बढ़ने से कणों की गति तेज हो जाती है, इसलिए हम कह सकते हैं कि तापमान बढ़ने से कणों की गतिज ऊर्जा भी बढ़ जाती है।
3-पदार्थ के कणों के बीच एक बल कार्य करता है।यह बाल कणों को एक साथ बांध के रखता है। इस आकर्षण बल का सामर्थ प्रत्येक पदार्थ में अलग-अलग होता है।
गतिज ऊर्जा:- गतिज ऊर्जा-किसी वस्तु में उसकी गति के कारण निहित ऊर्जा को गतिज ऊर्जा कहते हैं। जैसे-उड़ता हुआ हवाई जहाज, नदी में बहता हुआ पानी आदि में कार्य करने की क्षमता उनमें विद्यमान गतिज ऊर्जा के कारण है।
TOPIC NO.3-पदार्थ की अवस्थाएं
पदार्थ अपने तीन रूप में होते हैं।
1-ठोस
2-द्रव
3-गैस
पदार्थ की यह अवस्थाएं के कणों के विभिन्न विशेषताओं के कारण होती हैं।
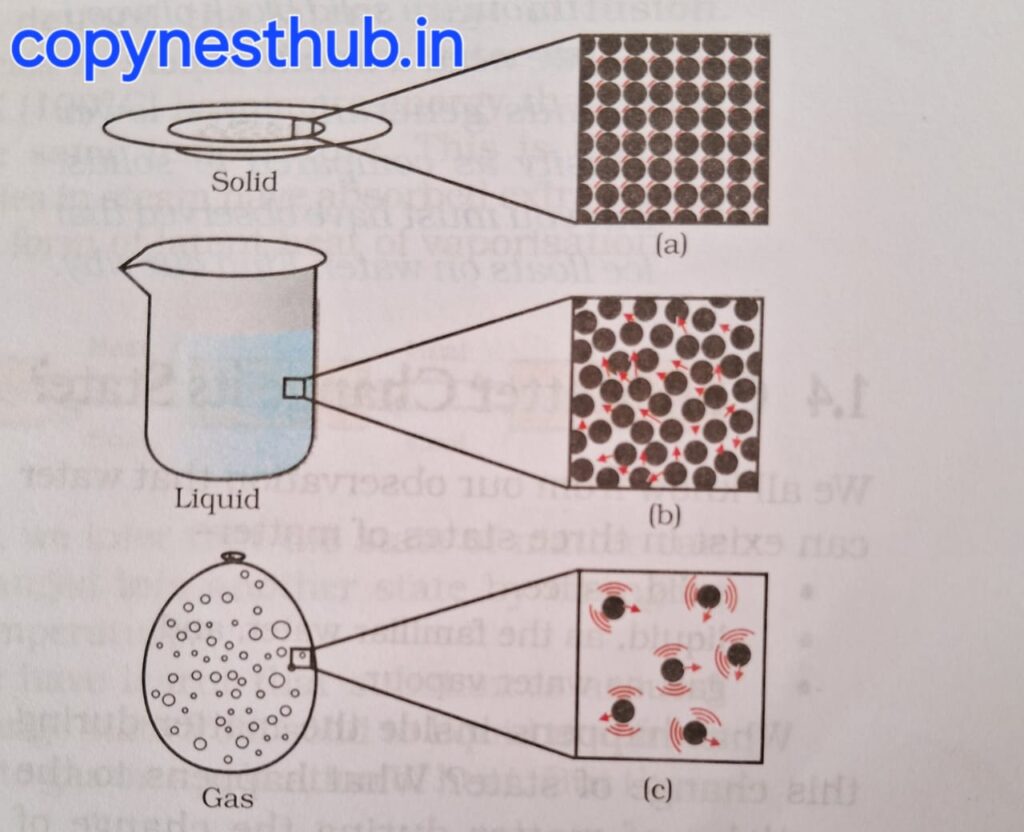
आकार,आकृति और आयतन क्या होता है?
आकार:- आकार को किसी वस्तु के आयामों के आधार पर मापा जाता है।
आकृति:- किसी वस्तु के दिखने के आधार पर होती है।
आयतन:- सभी त्रि-विमीय स्थान की मात्रा की माप को आयतन कहते हैं।
ठोस अवस्था:- इनका निश्चित आकार, स्पष्ट सीमाएं तथा स्थिर आयतन होता है।बाह्य बल लगाने पर ठोस अपने आकार को बनाए रखते हैं। बल लगाने पर ठोस टूट सकते हैं लेकिन उनके आकार नहीं बदलते है। ये दृढ़ होते हैं।
द्रव अवस्था:- इसका निश्चित आकार नहीं होता लेकिन आयतन निश्चित होता है।जिस बर्तन में इसे रखा जाता है वह उसी के आकार को ले लेता है।द्रव में बहाव होता है और उसका आकार बदलता है, इसलिए यह दृढ़ नहीं लेकिन तरल होते हैं।
विसरण:- दो विभिन्न पदार्थों के कणों का स्वतः मिलना ही विसरण कहलाता है।विसरण का मतलब है, किसी पदार्थ के कणों का ज़्यादा सांद्रता वाले क्षेत्र से कम सांद्रता वाले क्षेत्र की ओर गति करना।यह एक प्राकृतिक प्रक्रिया है।पदार्थों के अणुओं के परस्पर मिल जाने को विसरण कहते हैं।द्रव में ठोस, द्रव और गैस तीनों का विसरण संभव है। ठोस की अपेक्षा द्रव में विसरण की दर अधिक होती है क्योंकि द्रव अवस्था में पदार्थ के कण स्वतंत्र रूप से गति करते हैं और ठोस की अपेक्षा द्रव में कणों में रिक्त स्थान भी अधिक होता है।
गैसीय अवस्था:- इसका न ही कोई निश्चित आकार होता है और न ही कोई निश्चित आयतन होता है।कणों की तेज गति और अत्यधिक रिक्त स्थानों के कारण गैसों का अन्य गैसों में विसरण बहुत तेज़ होता है।
घनत्व:- किसी तत्व के द्रव्यमान प्रति इकाई आयतन को घनत्व कहते हैं।
FORMULA:- घनत्व=द्रव्यमान/आयतन
TOPIC NO.4-क्या पदार्थ अपनी अवस्था को बदल सकता है?
जल “पदार्थ की तीन अवस्थाओं” में रह सकता है।
ठोस के रूप में बर्फ, द्रव के रूप में जल एवं गैस के रूप में जलवाष्प।
तापमान परिवर्तन का प्रभाव:- ठोस के तापमान को बढ़ाने पर उसके कणों की गतिज ऊर्जा बढ़ जाती है। गतिज ऊर्जा में वृद्धि होने के कारण कण अधिक तेजी से कंपन करने लगते हैं। ऊष्मा के द्वारा प्रदत्त की गई ऊर्जा कणों के बीच के आकर्षण बल को पार कर लेती है।इस कारण कण अपने नियत स्थान को छोड़कर अधिक स्वतंत्र होकर गति करने लगते हैं। एक अवस्था ऐसी आती है जब ठोस पिघलकर द्रव में परिवर्तित हो जाता है।
गलनांक:- जिस तापमान पर ठोस पिघलकर द्रव बन जाता है,वह इसका गलनांक कहलाता है।
बर्फ का गलनांक 273.16 K (केल्विन) है।
किसी ठोस का गलनांक उसके कणों के बीच के आकर्षण बल के सामर्थ को दर्शाता है।
गलन की प्रक्रिया यानी ठोस से द्रव अवस्था में परिवर्तन को संगलन भी कहते हैं।
किसी ठोस के गलने की प्रक्रिया में तापमान समान रहता है।
गलनांक पर पहुंचने के बाद जब तक संपूर्ण बर्फ पिघल नहीं जाती तापमान नहीं बदलता है। ऊष्मा प्रदान करने के बावजूद भी ऐसा ही होता है। कणों की पारस्परिक आकर्षण बल को वशीभूत करके पदार्थ की अवस्था को बदलने में ऊष्मा का उपयोग होता है।
प्रसुप्त ऊष्मा:-वायुमंडलीय दाब पर 1kg ठोस को उसके गलनांक पर द्रव में बदलने के लिए जितनी ऊष्मा ऊर्जा की आवश्यकता होती है,उसे संगलन की प्रसुप्त ऊष्मा कहते हैं।
क्वथनांक:- वायुमंडलीय दाब पर वह तापमान जिस पर द्रव उबलने लगता है, उसे उसका क्वथनांक कहते हैं।जल का क्वथनांक 373K(केल्विन) है।
तापमान बदलकर हम पदार्थ को एक अवस्था से दूसरी अवस्था में बदल सकते हैं।
1-ठोस अवस्था- ऊष्मा- द्रव अवस्था
2-द्रव अवस्था- ऊष्मा- गैसीय अवस्था
1-गैसीय अवस्था- शीतलता- द्रव अवस्था
2-द्रव्य अवस्था – शीतलता- ठोस अवस्था
कुछ ऐसे भी पदार्थ है जो द्रव अवस्था में परिवर्तित हुए बिना ठोस अवस्था से सीधे गैस में और वापस ठोस में बदल जाते हैं।
उर्ध्वपातन:- द्रव अवस्था में परिवर्तित हुए बिना ठोस अवस्था से सीधे गैस और वापस ठोस में बदलने की प्रक्रिया को उर्ध्वपातन कहते है। उदाहरण – कपूर, नौशादर या अमोनियम क्लोराइड, आयोडीन इत्यादि।
सामान्यत किसी पदार्थ का क्वथनांक वायुमंडलीय दाब के कम होने से घट जाता है परंतु पदार्थ की गलनांक से अधिक ही रहता है। अब यदि किसी विशेष पदार्थ का सामान्य वायुमंडलीय दाब पर क्वथनांक उसी दाब पर पदार्थ के गलनांक से भी कम हो तो पदार्थ ठोस से द्रव अवस्था में जाने के पहले ही क्वथन द्वारा सीधे वाष्प में परिवर्तित हो जाएगा। उर्ध्वपातन होने वाले पदार्थ इसी प्रकार के होते हैं।
दाब परिवर्तन का प्रभाव: –दाब के बढ़ने और तापमान घटने से गैस द्रव में बदल सकती है।
जब वायुमंडलीय दाब का माप 1atm हो तो ठोस CO2 द्रव अवस्था में आए बिना सीधे गैस में परिवर्तित हो जाती है, यही कारण है की ठोस कार्बन डाइऑक्साइड को शुष्क बर्फ कहते हैं।
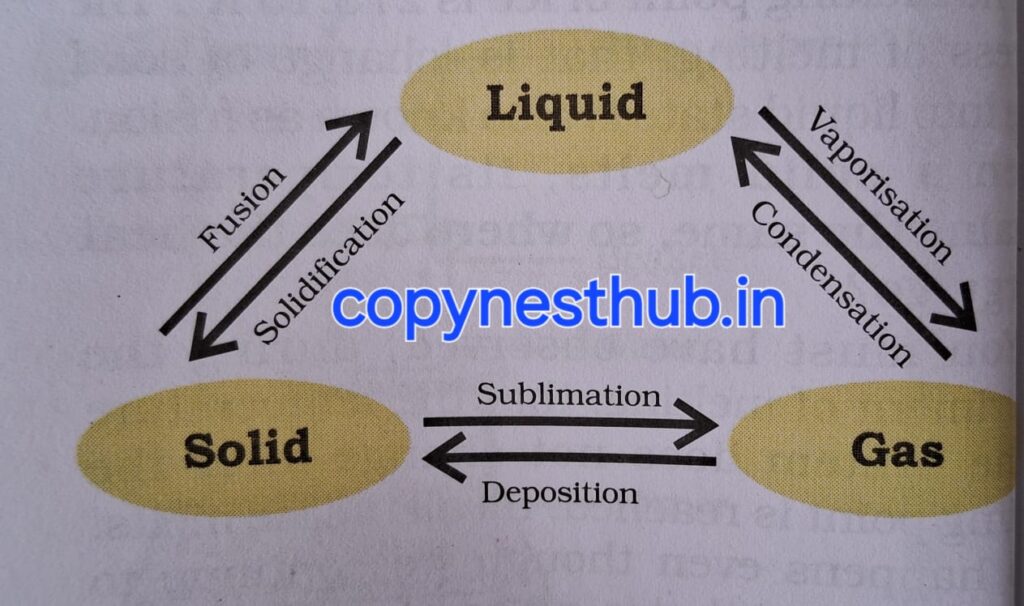
पदार्थ की अवस्थाएं यानी ठोस, द्रव और गैस दाब और तापमान के द्वारा तय होती हैं।
TOPIC NO.5-वाष्पीकरण
पदार्थ के कण हमेशा गतिशील होते हैं और कभी रुकते नहीं। द्रवों में सतह पर स्थित कणों के कुछ अंश में इतनी गतिज ऊर्जा होती है कि वे दूसरे कणों के आकर्षण बल से मुक्त हो जाते हैं।
वाष्पीकरण:- क्वथनांक से कम तापमान पर द्रव के वाष्प में परिवर्तन होने की प्रक्रिया को वाष्पीकरण कहते हैं।
द्रव का वाष्पन कमरे के ताप पर भी हो सकता है यद्यपि वह उच्चतर ताप पर तीव्रता से होता है।
वाष्पीकरण की क्रिया में केवल द्रव की सतह पर उपस्थित कण गैसीय अवस्था में पृथक होते हैं।
यह क्रिया धीरे-धीरे होती है। यह क्रिया वायु के प्रवाह की गति तथा वायु की आद्रता से प्रभावित होती है।
वाष्पीकरण को प्रभावित करने वाले कारक-
1-सतह क्षेत्र बढ़ने पर।
2-तापमान में वृद्धि होने पर आर्द्रता में कमी होने पर।
3-वायु की गति में वृद्धि होने पर।
आर्द्रता:- वायु में विद्यमान जलवाष्प की मात्रा को आद्रता कहते हैं।
एक निश्चित तापमान पर हमारे आसपास की वायु में एक निश्चित मात्रा में जलवाष्प होता है।
वाष्पीकरण के कारण शीतलता कैसे होती है?:- खुले हुए बर्तन में रखे द्रव में निरंतर वाष्पीकरण होता रहता है।वाष्पीकरण के दौरान कम हुई ऊर्जा को पुनः प्राप्त करने के लिए द्रव के कण अपने आसपास से ऊर्जा अवशोषित कर लेते हैं। इस तरह आसपास से ऊर्जा की अवशोषित होने के कारण शीतलता हो जाती है।उदाहरण के लिए- एसीटोन (नाखून की पॉलिश हटाने वाले द्रव) इत्यादि।
EXTRA
ठोस के कणों में आकर्षण बल सबसे अधिक, गैस के कणों में सबसे कम और द्रव के कणों में इन दोनों के मध्यवर्ती होते हैं।
ठोस के कणों में ठोसो को निहित करने वाले कणों के बीच का रिक्त स्थान और गतिज ऊर्जा न्यूनतम, गैसों के लिए अधिकतम किंतु द्रवों के लिए मध्यवर्ती है।
ठोसों के लिए उनके कण की व्यवस्था अत्यधिक क्रमित होती है।द्रव में कणों की परते फिसल सकती हैं। गैसों में कोई क्रम नहीं होता है।इनमें कण अनियमित रूप से विचरण करते हैं।
वाष्पीकरण की गुप्त ऊष्मा ताप की वह मात्रा है जो 1kg द्रव को वायुमंडलीय दाब और द्रव के क्वथनांक पर गैसीय अवस्था में परिवर्तित करने हेतु प्रयोग होती है।
संगलन की गुप्त ऊष्मा ताप की वह मात्रा है जो 1kg ठोस को वायुमंडलीय दाब पर ठोस को उसके संगलन बिंदु पर लाने के लिए प्रयोग होती है।
अब वैज्ञानिक पद्धति की पांच अवस्थाओं की चर्चा कर रहे हैं:-
1-बोस आइंस्टीन कंडेनसेट(BEC)
2-ठोस
3-द्रव
4-गैस
5-प्लाज्मा
प्लाज्मा:-इस अवस्था में कण अत्यधिक ऊर्जा वाले और अधिक उत्तेजित होते हैं। ये कण आयनीकृत गैस के रूप में होते हैं।
बोस आइंस्टीन कंडेनसेट(BEC):-सामान्य वायु घनत्व के एक लाखवें भाग जितने कम घनत्व वाली गैस को बहुत ही कम तापमान पर ठंडा करने से BEC तैयार होता है।
वर्ष 1920 में भारतीय भौतिक वैज्ञानिक सत्येंद्रनाथ बोस(1894-1974) ने पदार्थ की पांचवी व्यवस्था के लिए कुछ गणना की थी। इसी आधार पर अल्बर्ट आइंस्टीन(1879- 1955)ने पदार्थ की नई अवस्था की भविष्यवाणी की जिसे BEC कहा गया।
2001 में अमेरिका में की एरिक ए. कॉर्नेल, उल्फ़गैंग केटरले और कार्ल ई. वैमेन को BEC की अवस्था प्राप्त करने के लिए भौतिकी में नोबेल पुरस्कार से सम्मानित किया गया।
(atm):- गैसीय दाब के मापन का मात्रक है। दाब का SI मात्रक पास्कल(Pa) है।
1atm=1.01*100000 Pa
वायुमंडल में वायु का दाब वायुमंडलीय दाब कहलाता है।
समुद्र की सतह पर वायुमंडलीय दाब 1atm होता है और इसे सामान्य दाब कहा जाता है।
NOTE- 0 डिग्री सेल्सियस=273.16K or लगभग 273K
केल्विन से सेल्सियस में बदलने के लिए दिए हुए तापमान से 273 घटाना चाहिए।
सेल्सियस से केल्विन में बदलने के लिए दिए हुए तापमान में 273 जोड़ना चाहिए।
SI मात्रक:- SI मात्रक, अंतरराष्ट्रीय इकाई प्रणाली (International System of Units) को कहते हैं।
यह वैश्विक मानक है।इससे दुनिया के अलग-अलग देशों में एकरूपता बनी रहती है।
तनु विलयन:-जिस घोल में विलेय की मात्रा कम होती है, उसे तनु विलयन कहते हैं।तनु विलयन एक तरल पदार्थ होता है।तनु विलयन बनाने के लिए, विलेय की थोड़ी मात्रा को विलायक की बड़ी मात्रा में घोला जाता है।
सांद्र विलयन:- जिस विलयन में विलेय की मात्रा ज़्यादा होती है, उसे सांद्र विलयन कहते हैं।सांद्र विलयन एक तरल पदार्थ होता है।
क्रिस्टलीय:-क्रिस्टलीय ठोस, एक तरह का ठोस होता है जिसमें परमाणुओं या अणुओं का एक नियमित पैटर्न होता है.।इस पैटर्न को क्रिस्टल जालक कहते हैं।ज़्यादातर ठोस पदार्थ क्रिस्टलीय होते हैं।
अक्रिस्टलीय:- अक्रिस्टलीय ठोस उन ठोस पदार्थों को कहते हैं, जिनके अन्दर पर्याप्त दूरी तक परमाणुओं का कोई सुनिश्चित विन्यास नहीं होता।
समाकृतिकता:-जब दो यौगिक समान क्रिस्टलीय संरचना दिखाते हैं तो उन्हें समाकृतिक और इस परिघटना को समाकृतिकता कहा जाता है।
संसजन बल:- एक ही पदार्थ के अणु के बीच लगने वाला आकर्षण बल को संसजन बल कहते हैं।
आसंजन बल:- भिन्न-भिन्न पदार्थ के अणु के बीच लगने वाले आकर्षण बल को आसंजन बल कहते हैं।
LPG (FULL FORM) :- Liquefied Petroleum Gas
CNG (FULL FORM) :-Compressed Natural Gas
गलनांक:- वायुमंडल के मानक दाब पर कोई पदार्थ जिस निश्चित ताप पर ठोस अवस्था से द्रव अवस्था में परिवर्तित होता है।किसी ठोस में अपद्रव मिलाने पर उसका गलनांक कम हो जाता है।
हिमांक:-वायुमंडल के मानक दाब पर कोई पदार्थ जिस निश्चित ताप पर द्रव अवस्था से ठोस अवस्था में परिवर्तित होता है।
क्वाथनांक:-वायुमंडल के मानक दाब पर कोई पदार्थ जिस निश्चित ताप पर द्रव अवस्था से वाष्प अवस्था में परिवर्तित होता है।क्वथन की क्रिया एक निश्चित ताप पर होती है।क्वथन की क्रिया के में द्रव के प्रत्येक भाग में उपस्थित कण गैसीय अवस्था में पृथक होते हैं।यह क्रिया तेजी से होती है।यह क्रिया वायु के प्रवाह की गति तथा वायु की आर्द्रता से प्रभावित नहीं होती है।
द्रवणांक:- वायुमंडल के मानक दाब पर कोई पदार्थ जिस निश्चित ताप पर वाष्प अवस्था से द्रव अवस्था में परिवर्तित होता है।
क्रान्तिक ताप:-वह ताप जिससे अधिक ताप पर केवल दाब बढ़कर गैस को द्रवित नहीं किया जा सकता।उसे उस गैस का क्रांतिक ताप कहते हैं।
ओस और कोहरा में अंतर:- ओस रात में बनती है और सुबह दिखती है, जबकि कोहरा रात में बनता है और सुबह दिखता है।कोहरा एक निचला बादल होता है, जबकि ओस पानी की बूंद होती है।
दैनिक जीवन में ताप मापने के लिए ताप के सेल्सियस पैमाने का प्रयोग किया जाता है।ताप का केल्विन पैमाने नामक ताप का एक अन्य पैमाना है, जिसका उपयोग मुख्य रूप से शोध कार्य के लिए वैज्ञानिकों द्वारा किया जाता है। ताप मापने का SI मात्रक केल्विन है। इसे संकेत K द्वारा प्रदर्शित किया जाता हैं।
ताप के केल्विन पैमाने का लाभ यह है कि इस पैमाने पर सभी ताप धनात्मक होते हैं। केल्विन पैमाने पर बर्फ का गलनांक 273K और जल का क्वथनांक 373K होता है।
FORMULA- केल्विन पैमाने का ताप = सेल्सियस पैमाने का ताप+ 273
END OF THIS CHAPTER.
CHAPTER-क्या हमारे आसपास के पदार्थ शुद्ध हैं?

INTRODUCTION
एक साधारण व्यक्ति के लिए शुद्ध का अर्थ होता है की पदार्थ में कोई मिलावट न हो लेकिन वैज्ञानिकों के लिए यह सभी वस्तुएं विभिन्न पदार्थों के मिश्रण है, अतः शुद्ध नहीं है।उदाहरण दूध में वसा,जल,प्रोटीन इत्यादि का मिश्रण हैं।
शुद्ध पदार्थ:- शुद्ध पदार्थ वे पदार्थ होते हैं जो एक ही प्रकार के कणों से बने होते हैं और उनकी संरचना स्थिर होती है। दूसरे शब्दों में, शुद्ध पदार्थ में किसी भी तरह का मिश्रण नहीं होता है और सभी कण समान रासायनिक प्रकृति के होते हैं।
उदाहरण:तत्व:- सोना, चांदी, ऑक्सीजन, हाइड्रोजन। यौगिक:- पानी, चीनी, नमक।
जब एक वैज्ञानिक किसी पदार्थ को शुद्ध कहता है तो उसका तात्पर्य है कि उस पदार्थ में मौजूद सभी कण समान रासायनिक प्रकृति के हैं।एक शुद्ध पदार्थ एक ही प्रकार के कण से मिलकर बना होता है।
तत्व:-तत्व वह पदार्थ होता है जो केवल एक ही प्रकार के परमाणुओं से बने पदार्थों से बने होते हैं।जैसे कार्बन, सिलिकॉन,हाइड्रोजन आदि।
यौगिक:-जब दो या दो से ज़्यादा तत्व रासायनिक अभिक्रिया के ज़रिए जुड़ते हैं,तो एक नया पदार्थ बनता है जिसे यौगिक कहते हैं।
उदाहरण:पानी (H₂O), नमक (NaCl), और कार्बन डाइऑक्साइड (CO₂) यौगिकों के कुछ उदाहरण हैं।
अवयव:-अवयव शब्द का मतलब होता है – अंग, अंश, भाग,हिस्सा इत्यादि।उदाहरण:-खिचड़ी में कुछ अवयव
निम्न है:- दाल,चावल,हल्दी,नमक, पानी इत्यादि शामिल हैl
TOPIC NO.1- मिश्रण क्या है?
कुछ पदार्थ ऐसे होते हैं जिनमें दो या दो से अधिक तत्व या यौगिक किसी भी अनुपात में मिले रहते हैं,ऐसे पदार्थ को मिश्रण कहते हैं।
जब दो या दो से अधिक तत्व अथवा यौगिक को बिना किसी निश्चित अनुपात में मिलाया जाता है और किसी भी नई वस्तु का निर्माण नहीं होता है तो ऐसे पदार्थ को मिश्रण कहते हैं। इसमें अवयवी पदार्थ के गुण विद्यमान रहते हैं और इन्हें भौतिक विधियों द्वारा पृथक किया जा सकता है। उदाहरण:
वायु:- ऑक्सीजन,नाइट्रोजन,कार्बन डाइऑक्साइड, जलवाष्प इत्यादि।
बारूद- पोटेशियम नाइट्रेट(शोरा), गंधक, चारकोल।
पीतल-तांबा(Copper) और जस्ता(zinc)
इस्पात:-लोहा,कार्बन और अल्प मात्रा में क्रोमियम, मैग्नीशियम इत्यादि।
मिश्रण के प्रकार:-
अवयवों की प्रकृति के अनुसार विभिन्न प्रकार के मिश्रण का निर्माण होता है।इस तरह मिश्रण के कई प्रकार होते हैं:-
1-समांगी मिश्रण
2-विषमांगी मिश्रण
समांगी मिश्रण:- इसमें उपस्थित विभिन्न अवयवों की सीमाओं को पृथक रूप से देखा नहीं जा सकता है। उदाहरण:-चीनी का जल में मिश्रण एक समांगी मिश्रण है।ऐल्कोहॉलऔर जल का मिश्रण एक समांगी मिश्रण है।शुद्ध वायु भी समांगी मिश्रण है।
विषमांगी मिश्रण:- इसमें विभिन्न अवयवों के बीच पृथक्करण सीमा स्पष्ट रूप से दिखाई देती है।उदाहरण:-शक्कर और रेत का मिश्रण एक विषमांगी मिश्रण है।
पानी और पत्थर का मिश्रण एक विषमांगी मिश्रण है।
TOPIC NO.2- विलयन क्या है?
विलियन दो या दो से अधिक पदार्थ का समांगी मिश्रण है। उदाहरण नींबू जल, सोडा जल आदि विलयन के उदाहरण है।
अन्य परिभाषा- दो या दो से अधिक पदार्थों के ऐसे समांगी मिश्रण जिसका कोई निश्चित संगठन नहीं होता अर्थात पदार्थ की मात्राओं का कोई निश्चित अनुपात नहीं होता विलियन कहलाता है।प्राय: हम एक विलयन को ऐसे तरल पदार्थ के रूप में विचार करते हैं,जिसमें ठोस, द्रव या गैस मिले हो लेकिन प्रकृति में ठोस विलियन (मिश्र धातु) और गैसीय विलियन (वायु)भी होते हैं।एक विलयन के कण में समांगिकता होती है।
मिश्र धातु:- यह धातुओं के समांगी मिश्रण होते हैं,जिन्हें भौतिक क्रिया द्वारा पृथक नहीं किया जा सकता लेकिन फिर भी मिश्र धातुओं को मिश्रण माना जाता है, क्योंकि यह अपने घटकों के गुण को दर्शाते हैं।यह पृथक-पृथक संगठन रखते हैं। उदाहरण के लिए पीतल जिंक(30%) और कॉपर(70%) का मिश्रण है।
विलयन के प्रकार- विलायक तथा विलेय की भौतिक अवस्थाओं (ठोस, द्रव या गैस) के अनुसार निम्नलिखित नौ प्रकार की विलयन होते हैं:-
गैस-गैस( वायु किन्हीं दो या दो से अधिक गैसों का मिश्रण)
गैस-द्रव(जल में धुली वायु, सोडा वाटर)
गैस-ठोस(चारकोल में अधिशोषित गैस)
द्रव-गैस( कोहरा,कुहासा)
द्रव-द्रव( जल में अल्कोहल)
द्रव-ठोस( जिंक में धुला हुआ मरकरी)- अमलगम
गैस-ठोस( वायु में धूल के कण)
ठोस-द्रव( नमक,चीनी आदि के जलीय विलियन)
ठोस-ठोस(पीतल आदि मिश्र धातु)
सांद्रण:- किसी मिश्रण में मौजूद किसी घटक या अवयव की मात्रा को सांद्रण कहते हैं।
सांद्रण के आधार पर विलियम निम्नलिखित दो प्रकार के हो सकते हैं-
1-संतृप्त विलियन
2-असंतृप्त विलियन
संतृप्त विलियन- संतृप्त विलियन वह होता है जिसमें विलायक में विलेय की किसी ताप पर अधिकतम संभव मात्रा उपस्थिति रहती है।संतृप्त विलयन की पहचान यह है कि उसके संपर्क में कुछ बिना खुला हुआ विलय भी उपस्थित हो।
असंतृप्त विलियन- असंतृप्त विलियन वह होता है जिसमें विलेय की मात्रा उस ताप पर संतृप्तता की आवश्यक मात्रा से कम हो।असंतृप्त विलयन में और अधिक विलेय मिलाने से वह तब तक धुलता जाता है, जब तक की विलियन संतृप्त ना हो जाए।
विलयन की स्वतंत्रता पर ताप का प्रभाव- यदि किसी संतृप्त विलियन का ताप बढ़ाया जाए तो उसमें और अधिक विलेय धुलता जाता है।इसके विपरीत यदि किसी और संतृप्त विलयन को ठंडा करके उसका ताप घटाया जाए तो एक निश्चित ताप पर विलयन संतृप्त हो जाता है और उसे ठंडा करने पर विलेय विलयन से अलग होकर बर्तन की तली में जमा होने लगता है।संतृप्त विलियन ताप बढ़ने पर और असंतृप्त तथा असंतृप्त विलियन ताप घटाने पर संतृप्त हो जाते हैं।
विलयन:- विलेय और विलायक को मिलाने पर विलयन बनता है। उदाहरण:-चीनी और जल का विलियन,आयोडीन और अल्कोहल का विलयन इत्यादि।
विलायक( इसकी मात्रा दूसरे से अधिक):- विलियन का वह घटक जो दूसरे घटक को विलयन में मिलाता है,उसे विलायक कहते हैं।
विलेय( कम मात्रा में होता है):- विलयन का वह घटक जो कि विलायक में घुला होता है,उसे विलेय कहते है।
विलयन के अभिलक्षण या गुण:-
1-विलियन एक समांगी मिश्रण होता है।
2-विलयन के कण व्यास में 1nm से भी छोटे होते हैं, इसलिए वह आंख से नहीं दिखाई देखें देते हैं,इसलिए वह आंख से नहीं दिखाई देते हैं।
3-अपने छोटे आकार के कारण विलयन के कण गुजर रही प्रकाश की किरण को फैलाते नहीं है,इसलिए विलियन में प्रकाश का मार्ग दिखाई नहीं देता है।
4-छानने की विधि द्वारा कण को विलयन से पृथक नहीं किया जा सकता,। विलयन को शांत छोड़ देने पर भी विलय के कण नीचे नहीं बैठते हैं अर्थात विलयन स्थाई है।
विलयन की सांद्रता- विलियन में पृथक-पृथक मात्रा में विलायक और विलेय पदार्थ होते हैं।
विलियन में मौजूद विलेय पदार्थ की मात्रा के आधार पर इसे तनु,सान्द्र कहा जा सकता है।तनु,सान्द्र एक तुलनात्मक शब्द है।
किसी निश्चित तापमान पर उतना ही विलेय पदार्थ घुल सकता है, जितनी की विलयन की क्षमता होती है।
संतृप्त विलियन:-एक निश्चित तापमान पर यदि विलियन में विलेय पदार्थ नहीं घुलता है, तो उसे संतृप्त विलियन कहते हैं।
घुलनशीलता:-विलेय पदार्थ की वह मात्रा जो एक निश्चित ताप पर संतृप्त विलियन में उपस्थित होती है, उसकी घुलनशीलता कहलाती है।
असंतृप्त विलियन:- यदि एक विलयन में विलेय पदार्थ की मात्रा संतृप्तता से कम है, तो इसे असंतृप्त विलियन कहा जाता है।
सांद्रता:-किसी निश्चित ताप पर विलायक या विलयन की दी गई मात्रा या द्रव्यमान में उपस्थित विलेय की मात्रा विलयन की सांद्रता कहलाती है।
FORMULA- विलयन की सांद्रता = विलेय की मात्रा/ विलयन की मात्रा
FORMULA- विलयन की सांद्रता=विलेय की मात्रा/ विलायक की मात्रा
विलयन की सांद्रता को दर्शाने के लिए बहुत सी राशियों उपस्थित है,परंतु इनमें से सरलतम निम्न है:-
FORMULA- विलयन का द्रव्यमान प्रतिशत= विलेय का द्रव्यमान/ विलयन का द्रव्यमान*100
FORMULA- विलयन का आयतन प्रतिशत= विलेय का द्रव्यमान/ विलयन का आयतन*100
FORMULA- विलयन का आयतन प्रतिशत= विलेय का आयतन/ विलयन का आयतन*100
निलंबन:- यह एक विषमांगी मिश्रण है,जिसमें ठोस के छोटे-छोटे कण पूरे द्रव में बिना घुले फैले रहते हैं। निलंबन में ठोस कणों के आकार पर्याप्त बड़े होते हैं।निलंबन में निलंबित कण को नग्न आंखों से भी देखा जा सकता है।उदाहरण:- मटमैला पान, पेंट, दूध, जल में निलंबित रेत,आटा-जल मिश्रण इत्यादि।
निलंबन के गुण:-
1-यह एक विषमांगी मिश्रण है।
2-यह कण आंखों से देखे जा सकते हैं।
3-यह निलंबित कण प्रकाश की किरण को फैला देते हैं, जिससे इसका मार्ग दृष्टिगोचर होता है।
4-जब इसे शांत छोड़ दिया जाता है तो यह कण नीचे की ओर बैठ जाते हैं, अर्थात निलंबन अस्थाई होता है।
5-छानन विधि द्वारा इन कणों को मिश्रण से पृथक किया जा सकता है।
जब सभी कण नीचे बैठ जाते हैं, तो निलंबन समाप्त हो जाता है तथा विलयन में प्रकाश की किरण का प्रकीर्णन रुक जाता है।
कोलाइडल विलयन:- यह एक प्रकार का विलयन है जिसमें विलेय कण का आकार वास्तविक विलयन के कण की अपेक्षा बड़ा परंतु निलंबन के कण की अपेक्षा छोटा होता है।
कोलाइडल के कण विलयन में समान रूप से फैले होते हैं। निलंबन की अपेक्षा कण का आकार छोटा होने के कारण यह मिश्रण संमागी प्रतीत होता है,लेकिन वास्तविकता में यह विलयन विषमांगी मिश्रण है।उदाहरण:- स्टार्च विलयन,दूध, स्याही, रक्त, साबुन का विलन, टूथपेस्ट, संश्लेषित अपमार्जक का विलयन।
कोलाइडल हमें संमागी प्रतीत होते हैं परंतु जब उच्च शक्ति के सूक्ष्मदर्शी से देखते हैं,तो यह वास्तव में विषमांगी पाए जाते हैं।
कोलाइडल कण के छोटे आकार के कारण हम इसे आंख से नहीं देख सकते,लेकिन यह कण प्रकाश की किरण को आसानी से फैला देते हैं।
टिंडल प्रभाव:- प्रकाश की किरण का फैलना टिंडल प्रभाव कहा जाता है। टिंडल नामक वैज्ञानिक ने इसकी खोज की थी।
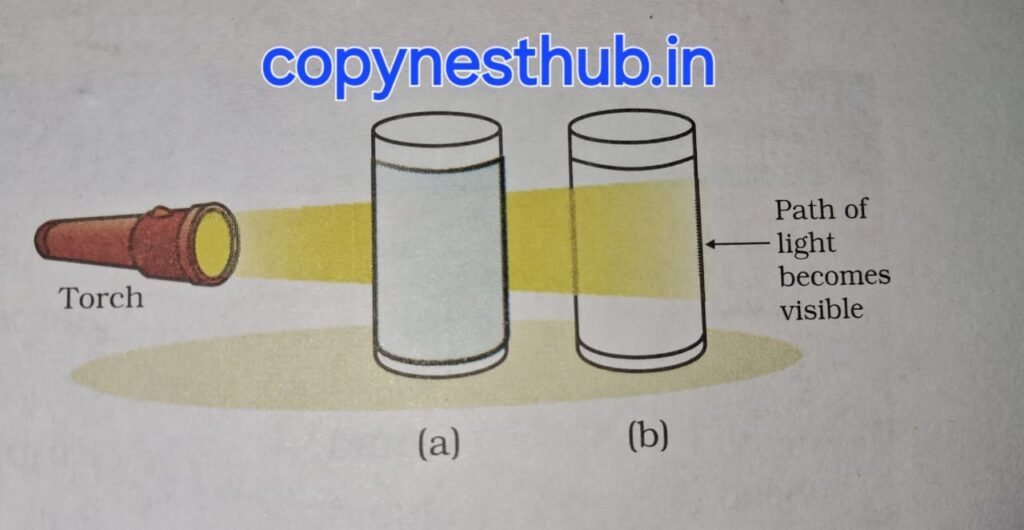
एक कमरे में छोटे छिद्र के द्वारा जब प्रकाश की किरण आती है, तब वहां पर हम टिंडल प्रभाव को देख सकते हैं।यह कमरे में मौजूद धूल और कार्बन के कण द्वारा प्रकाश के फैलने के कारण होता है।
कोलाइडल के गुण:-
1-यह संमागी दिखाई देता है परंतु यह एक विषमांगी मिश्रण है।
2-इसके विलेय कण का आकार वास्तविक विलयन से बड़ा परंतु निलंबन से छोटा होता है।
3-कोलाइडल के कणों का आकार इतना छोटा होता है कि यह पृथक रूप से आंखों से नहीं देखे जा सकते हैं।
4-सामान्यत: कोलाइडल के कण सूक्ष्मदर्शी से भी नहीं देखे जा सकते हैं।
5-इसके कण इतने बड़े होते हैं कि प्रकाश की किरण को फैलाते हैं तथा उसके मार्ग को दृश्य बनाते हैं।
6-जब इनको शांत छोड़ दिया जाता है,तब यह कण तल पर बैठते हैं अर्थात यह स्थाई होते हैं।
7-यह छानन विधि द्वारा मिश्रण से पृथक नहीं किया जा सकते किंतु एक विशेष विधि अपकेंद्रीकरण तकनीक द्वारा पृथक किया जा सकते हैं।
8-कोलाइडल विलयन के कण सदैव टेढ़ी-मेढ़ी गति करते रहते हैं, जिसे ब्राउनी गति कहते हैं।
ब्राउनी गति:- किसी तरल पदार्थ में निलंबित छोटे-छोटे कणों को सतत गति ब्राउनी गति कहलाती है। ऐसा इन कणों के तरल पदार्थ के अणुओं में लगातार टकराने के कारण होता है।
TOPIC NO.3- भौतिक एवं रासायनिक परिवर्तन
पदार्थ की भौतिक गुण निम्न है:-
1-रंग
2-कठोरता
3-दृढ़ता
4-बहाव
5-घनत्व
6-द्रवानांक
7-क्वथनांक इत्यादि भौतिक गुण कहे जाते हैं।
भौतिक परिवर्तन:- वह परिवर्तन जिसमें कोई नया पदार्थ नहीं बनता है, उसे भौतिक परिवर्तन कहते हैं।इसमें पदार्थ की पहचान परिवर्तित नहीं होती है। यह एक उत्क्रमित परिवर्तन है।भौतिक परिवर्तन की कुछ उदाहरण:-बर्फ का गलन, जल का हिमिकरण ,जल का भाप बनना,विलयन बनाना, विद्युत बल्ब का चमकना, कांच की गिलास का टूटना इत्यादि।
रासायनिक परिवर्तन;- वह परिवर्तन जिसमें नए पदार्थ बनते हैं,उसे रासायनिक परिवर्तन कहते हैं। इसमें पदार्थ की पहचान बदल जाती है।यह एक अनुत्त्क्रमित परिवर्तन है।रासायनिक परिवर्तन के कुछ उदाहरण:
कागज का जलना, लोहे में जंग लगना,दूध से दही बनना,भोजन का पकना इत्यादि।
TOPIC NO.4- शुद्ध पदार्थ की क्या प्रकार हैं?
पदार्थ को उनके रासायनिक संगठन के आधार पर तत्वों या यौगिक में वर्गीकृत किया जा सकता है।
तत्व:- यह एक ऐसा शुद्ध द्रव है, जिसे साधारण भौतिक या रासायनिक विधियों(ऊष्मा,प्रकाश, विद्युत ऊर्जा) द्वारा दो या दो से अधिक अन्य सरल पदार्थ में विभाजित नहीं किया जा सकता।
रॉबर्ट बायल पहले वैज्ञानिक थे जिन्होंने सन् 1661 में सर्वप्रथम तत्व शब्द का प्रयोग किया था।
तत्वों को सामान्यत: धातु,अधातु तथा उपधातु में वर्गीकृत किया गया है।
धातु:- वह तत्व जो सामान्य अभिक्रियाओं में अपने परमाणुओं से एक या एक से अधिक इलेक्ट्रॉन त्याग कर धनायन बनाने की प्रवृत्ति रखते हैं।( हाइड्रोजन को छोड़कर) उदाहरण के लिए सोना, चांदी,तालाब, लोहा, सोडियम, पोटैशियम इत्यादि।इसको इलेक्ट्रो पॉजिटिव तत्व भी कहते हैं।
धातुओं के गुण निम्न होते हैं:-
1-यह चमकीली होती है।
2-यह ताप तथा विद्युत की सुचालक होती है।
3-इसको तार के रूप में खींचा जा सकता है।
4-इसको पीटकर महीन चादरों में ढाला जा सकता है।
5-यह प्रतिध्वनि उत्पन्न करते हैं।
अधातु:-वह तत्व जो सामान्य अभिक्रियाओं में एक या एक से अधिक इलेक्ट्रॉन ग्रहण कर ऋण आयन बनाने की प्रवृत्ति रखते हैं। उदाहरण के लिए हाइड्रोजन, ऑक्सीजन,आयोडीन, कार्बन, ब्रोमीन क्लोरीन इत्यादि।इसे इलेक्ट्रो निगेटिव तत्व भी कहते हैं।
अधातुओं के गुण निम्न होते हैं:-
1-यह विभिन्न रंगों के होते हैं।
2-यह ताप तथा विद्युत की कुचालक होती है।
3-यह चमकीली नहीं होती है।(अपवाद- हीरा ग्रेफाइट)
4-इसको तार के रूप में नहीं खींचा जा सकता है।
5-इसको पीटकर महीन चादरों में नहीं ढाला जा सकता है।
6-यह भंगुर होता है।
उपधातु:- कुछ तत्व धातु और अधातु के बीच के गुण को दर्शाते हैं,जिन्हें उपधातु कहा जाता है।जैसे-आर्सेनिक, एंटीमनी,सिलिकॉन, जर्मेनियम, बोरान इत्यादि।
अभी तक ज्ञात तत्वों की संख्या 100 से अधिक है।इनमें से 92 तत्व प्राकृतिक है,जबकि शेष तत्व मानव निर्मित है।अधिकतर तत्व ठोस हैं।11 तत्व कमरे की तापमान पर गैस है।2 तत्व पारा और ब्रोमीन कमरे के तापमान पर द्रव है।
यौगिक:- यह ऐसा शुद्ध द्रव है, जो द्रव्यमान के अनुसार दो या दो से अधिक तत्वों के निश्चित अनुपात में रासायनिक संयोग से बना होता है। उदाहरण के लिए जल ,शर्करा,कार्बन डाइऑक्साइड,नमक इत्यादि।
मिश्रण और यौगिक में अंतर:-
मिश्रण:-मिश्रण से इसके अवयवी पदार्थों को भौतिक विधियों जैसे छानना,वाष्पन, उर्ध्वपातन इत्यादि द्वारा पृथक किया जा सकता है।मिश्रण में इसके अवयवी पदार्थों के सभी गुणधर्म पाए जाते हैं।मिश्रण के बनते समय ऊर्जा न तो शोषित होती है न मुक्त होती है।मिश्रण का संगठन अनिश्चित होता है।इसके अवयव द्रव्यमान में किसी भी अनुपात में हो सकते हैं।मिश्रण के गलनांक ,क्वथनांक, घनत्व इत्यादि निश्चित नहीं होते हैं।विलियन जो की समांग होता है,को छोड़कर मिश्रण प्राय: विषमांग होते हैं।मिश्रण में दो या दो से अधिक प्रकार के अणु हो सकते हैं।
यौगिक:-यौगिक से इसके अवयव को भौतिक विधियों द्वारा पृथक नहीं किया जा सकता है।यौगिक के गुणधर्म इसके अवयवी पदार्थ से भिन्न होते हैं।यौगिक के बनते समय ऊर्जा या तो शोषित होती है या मुक्त होती है।यौगिक का संगठन निश्चित होता है।यौगिक में इसके अवयव द्रव्यमान के एक निश्चित अनुपात में होते हैं।यौगिक के गलनांक,क्वथनांक एवं घनत्व निश्चित होते हैं।योगिक समांग होते हैं।योगिक में एक ही प्रकार के अणु होते हैं।
EXTRA
शुद्ध पदार्थ वह पदार्थ होते हैं जिनका दिए हुए तापमान तथा दाब पर रंग, आकार,स्वाद तथा स्वभाव एक ही जैसा होता है।
विलयन के प्रति इकाई द्रव्यमान में अथवा प्रति इकाई आयतन में उपस्थित विलेय पदार्थ की मात्रा विलयन की सांद्रता कहलाती है।
परिक्षिप्त प्रावस्था:-यह वह पदार्थ है जो छोटी कणों के रूप में परिक्षेपण माध्यम में फैले हुए होते हैं।यह एक ठोस, तरल या गैस हो सकती है।उदाहरण:-बादल में, पानी (तरल) परिक्षिप्त प्रावस्था है और हवा (गैस) परिक्षेपण माध्यम है।
परिक्षेपण माध्यम:-यह वह माध्यम है जिसमें परिक्षिप्त प्रावस्था फैले हुए होते हैं।यह भी एक ठोस, तरल या गैस हो सकता है।
उदाहरण:दूध में, वसा (तैल) परिक्षिप्त प्रावस्था है और पानी परिक्षेपण माध्यम है।
एरोसोल:- वह कोलाइडल विलियन जिसमे परिक्षेपण प्रावस्था माध्यम द्रव तथा परिक्षिप्त प्रावस्था गैस होती है। जैसे कोहरा व बादल।
जेल:-वह कोलाइडल विलियन जिसमे परिक्षेपण प्रावस्था माध्यम द्रव तथा परिक्षिप्त प्रावस्था ठोस होती है। जैसे जेली ,पनीर।
ठोस साॅल-वह कोलाइडल विलियन जिसमे परिक्षेपण प्रावस्था माध्यम तथा परिक्षिप्त प्रावस्था दोनों ही ठोस होती है। जैसे रत्न, पत्थर(नग) इत्यादि।
आयोडीन टिंचर:- एक एंटीसेप्टिक घोल है जिसमें आयोडीन होता है, जो एक कमजोर आयोडीन घोल है। यह इथेनॉल(एथेनॉल एक प्रसिद्ध अल्कोहल है। इसे एथिल अल्कोहल भी कहते हैं) और पानी के मिश्रण में आयोडीन को घोलकर बनाया जाता है।
इसे आयोडीन घोल या कमजोर आयोडीन घोल भी कहा जाता है।
निम्न समांगी प्रकृति के हैं:-
बर्फ,वायु,पीतल, स्टील, नमक का जलीय विलियन,चीनी का जलीय घोल,सोडा जल,सिरका, छनी हुई चाय।
निम्न विषमांगी प्रकृति के हैं:-
मृदा, लकड़ी, मिट्टी मिला जल।
निम्न रासायनिक परिवर्तन है:-
लोहे में जंग लगना, लकड़ी का दहन, लकड़ी का क्षरण।
निम्न भौतिक परिवर्तन है:-
लोहे की धातु का पिघलना, लोहे के क्षण को मोड़ना, लोहे की धातु को एक तार के रूप में खींचना,लकड़ी का चीरना, लकड़ी के टुकड़े में कील ठोकना।
निलंबन के कण पृथक्करण फनल द्वारा दूर किया जा सकते हैं।
जलीय विलियन:- विलेय का जल में विलयन जलीय विलयन कहलाता है।
अजलीय विलियन:-वह विलयन होता है जिसमें जल के अलावा अन्य तरल पदार्थ विलायक के रूप में उपयोग किए जाते हैं। उदाहरण के लिए, इथेनॉल, एसीटोन, बेंजीन या कार्बन टेट्राक्लोराइड जैसे तरल पदार्थ अजलीय विलयन बनाने के लिए विलायक के रूप में उपयोग किए जा सकते हैं।
वायु एक मिश्रण है,यौगिक नहीं। इसका मतलब है कि वायु में विभिन्न गैसें (जैसे नाइट्रोजन, ऑक्सीजन, आर्गन) मौजूद हैं, जो एक दूसरे के साथ रासायनिक रूप से जुड़ी नहीं हैं और उन्हें भौतिक साधनों से अलग किया जा सकता है।
मिश्रण:- मिश्रण में दो या दो से अधिक पदार्थ होते हैं जो भौतिक रूप से एक साथ मिश्रित होते हैं, लेकिन रासायनिक रूप से एक-दूसरे से बंधे नहीं होते हैं।
यौगिक:- यौगिक में दो या दो से अधिक तत्व होते हैं जो रासायनिक रूप से एक साथ बंधे होते हैं, जिससे एक नया पदार्थ बनता है।
वायु का मिश्रण:- वायु में मुख्य रूप से नाइट्रोजन, ऑक्सीजन और आर्गन जैसी गैसें होती हैं जो एक-दूसरे के साथ रासायनिक रूप से नहीं जुड़ी होती हैं।उदाहरण:पानी एक यौगिक है क्योंकि यह हाइड्रोजन और ऑक्सीजन तत्वों से रासायनिक रूप से जुड़ा होता है। नमक का पानी एक मिश्रण है क्योंकि नमक पानी में भौतिक रूप से घुल जाता है।
वायु के घटकों को भौतिक तरीकों से, जैसे भिन्नात्मक आसवन, से अलग किया जा सकता है।उदाहरण:नाइट्रोजन और ऑक्सीजन को भौतिक तरीकों से अलग किया जा सकता है।हवा में उपस्थित धूल और अन्य कण भी भौतिक रूप से अलग हो सकते हैं।वायु में विभिन्न गैसें होती हैं जो एक-दूसरे के साथ रासायनिक रूप से नहीं जुड़ी होती हैं और उन्हें भौतिक तरीकों से अलग किया जा सकता है, इसलिए यह एक मिश्रण है, यौगिक नहीं।
वायु एक समांगी मिश्रण है। इसमें नाइट्रोजन, ऑक्सीजन, और अन्य गैसें एक समान रूप से फैली हुई हैं, इसलिए इसका कोई भी हिस्सा दूसरे से अलग नहीं दिख सकता है।
कुछ महत्वपूर्ण कोलॉयडल विलियन:-
साबुन का जलीय विलियन,दूध,स्टार्च विलियन,रक्त इत्यादि।
कुछ महत्वपूर्ण वास्तविक विलयन:-
शर्करा विलयन,चीनी का विलियन,कॉपर सल्फेट विलियन,नमक विलियन इत्यादि।
वायु की घटक गैस(नाइट्रोजन,ऑक्सीजन तथा आर्गन) को उनके क्वथनांक के बढ़ते क्रम में व्यवस्थित करने का निम्न प्रकार है:- ऑक्सीजन -183 डिग्री सेल्सियस,आर्गन -186 डिग्री सेल्सियस,नाइट्रोजन -196 डिग्री सेल्सियस।
END OF THIS CHAPTER.
CHAPTER- जीवन की मौलिक इकाई

INTRODUCTION
जीवन की मौलिक इकाई कोशिका को कहा जाता है।
कोशिका:- इसे अंग्रेजी में (cell) कहते हैं,जीवित चीजों की सबसे छोटी कार्यात्मक इकाई है। यह सभी जीवित जीवों की संरचनात्मक, कार्यात्मक और जैविक इकाई है, और जीवन की सभी बुनियादी प्रक्रियाओं को करने में सक्षम है।
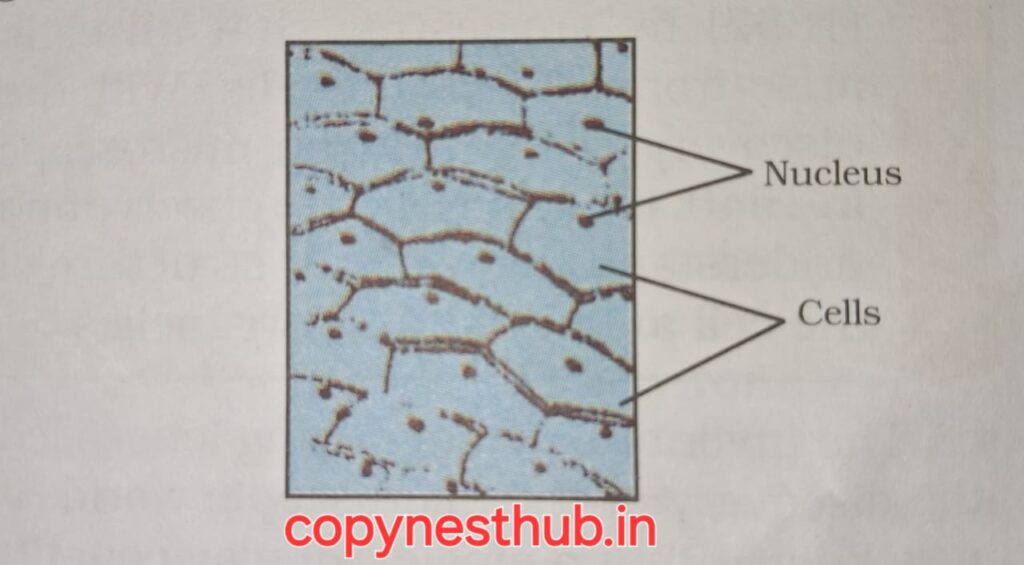
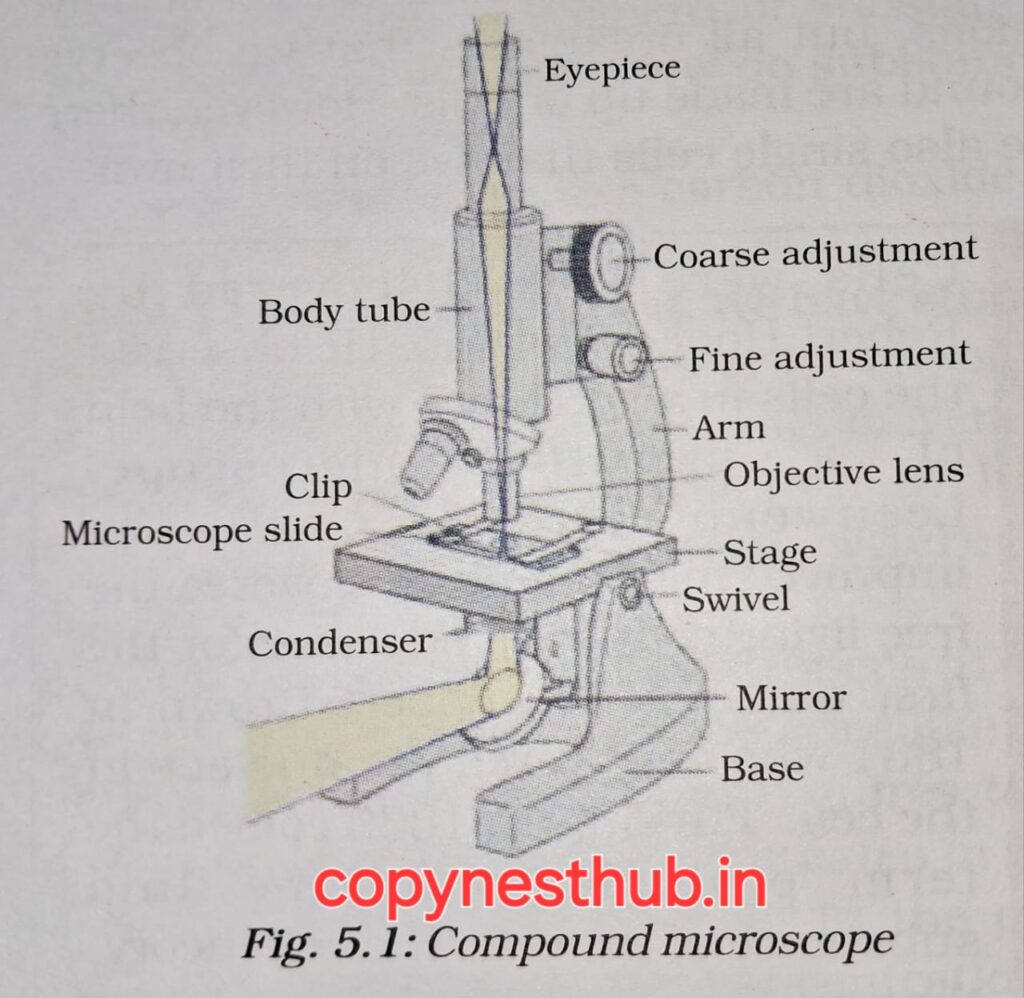
सन 1665 में रॉबर्ट हुक ने कार्क( एक पदार्थ है जो वृक्ष की छाल से प्राप्त होता है) मे स्वनिर्मित सूक्ष्मदर्शी से विभिन्न प्रकोष्ठ देखा। रॉबर्ट हुक ने इन प्रकोष्ठों को कोशिका कहा।
कोशिका लैटिन शब्द है, जिसका अर्थ है छोटा कैमरा।
सूक्ष्मदर्शी:- एक ऐसा उपकरण है जो वस्तुओं को बड़ा करके देखने के लिए लेंसों का उपयोग करता है।
सरल सूक्ष्मदर्शी:- जिसमें केवल एक लेंस होता है।
संयुक्त सूक्ष्मदर्शी:- इसमें दो या अधिक लेंस होते हैं, जो वस्तु को और अधिक आवर्धित करके देखने में मदद करते हैं।
जितने भी जीव जंतु हम अपने आसपास देखते हैं, वे सभी कोशिकाओं से बने होते हैं।
एकमात्र कोशिका स्वयं में ही एक संपूर्ण जीव है:-जैसे अमीबा, क्लेमिडोमोनास, पैरामीशियम तथा बैक्टीरिया। इन सजीवों को एककोशिकीय जीव कहते हैं।इसके अतिरिक्त बहुकोशिकीय जीवो में अनेक कोशिकाएं समाहित होकर विभिन्न कार्य को संपन्न करने हेतु विभिन्न अंगों का निर्माण करती हैं। इसके कुछ उदाहरण है:-कवक(Fungi),पादप, जंतु।
TOPIC NO.1- सजीव किससे बने होते हैं?
जितने भी जीव जंतु हम अपने आसपास देखते हैं, वे सभी कोशिकाओं से बने होते हैं।
एकमात्र कोशिका स्वयं में ही एक संपूर्ण जीव है:-जैसे अमीबा, क्लेमिडोमोनास, पैरामीशियम तथा बैक्टीरिया। इन सजीवों को एककोशिकीय जीव कहते हैं।इसके अतिरिक्त बहुकोशिकीय जीवो में अनेक कोशिकाएं समाहित होकर विभिन्न कार्य को संपन्न करने हेतु विभिन्न अंगों का निर्माण करती हैं। इसके कुछ उदाहरण है:-कवक(Fungi),पादप, जंतु।
प्रत्येक जीव एक कोशिका से ही विकसित होता है। कोशिकाएं विभाजित होकर अपनी ही जैसी कोशिकाएं बनाती है। इस प्रकार सभी कोशिकाएं अपने पूर्ववर्ती कोशिकाओं से उत्पन्न होती है।
एककोशिकीय तथा बहुकोशिकीय जीवो में अंतर:-
एक कोशिकीय जीव का शरीर एक कोशिका से बना होता है। जीवो की कोशिका की क्षति होने से जीव की मृत्यु हो जाती है। एक ही कोशिका द्वारा मृत्यु से पहले ही जीवद्रव का विभाजन कर देने से जीवद्रव की निरंतरता बनी रहती है, इसलिए यह एक कोशिकीय जीव अमर कहलाते हैं। एक मात्र कोशिका जनन में भाग लेती है। जैसे-बैक्टीरिया,अमीबा,यीस्ट,पैरामीशियम
क्लैमाइडोमोनास,यूग्लीना इत्यादि।
बहुकोशिकीय जीव का शरीर अनेक कोशिकाओं से बना होता है।एक कोशिका की मृत्यु का जीव पर बहुत अधिक प्रभाव नहीं होता है। इनका जीवन काल अपेक्षाकृत बड़ा होता है। बहुकोशिकीय जीव को अमर नहीं माना जा सकता है। इनका केवल विशिष्ट कोशिका जनन में भाग लेते हैं। जैसे-मनुष्य, जंतु,पादप इत्यादि।
CELL-TISSUE -ORGAN-ORGAN SYSTEM
कोशिका का सबसे पहले पता रॉबर्ट हुक ने 1665 में लगाया था।एंटोनी वॉन ल्यूवेनहक 1674 सबसे पहले उन्नत सूक्ष्मदर्शी से तालाब के जल में स्वतंत्र रूप से जीवित कोशिकाओं का पता लगाया।रॉबर्ट ब्राउन ने 1831 में कोशिका में केंद्रक का पता लगाया। J.E पुरोकंज 1839 में कोशिका में स्थित तरल जैविक पदार्थ को जीवद्रव का नाम दिया।एम. स्लीडन 1838 तथा टी. स्वान 1839 ने कोशिका सिद्धांत की विषय में बताया। विरचो 1855 में कोशिका सिद्धांत को और आगे बढ़ाया।
1940 में इलेक्ट्रॉन सूक्ष्मदर्शी की खोज के बाद कोशिका की जटिल संरचना तथा बहुत से अंग को समझना संभव हो सका।
इलेक्ट्रॉन सूक्ष्मदर्शी:-इलेक्ट्रॉन माइक्रोस्कोप एक ऐसा उपकरण है जो वस्तुओं को देखने के लिए प्रकाश के बजाय इलेक्ट्रॉनों की किरण का उपयोग करता है, जिससे बहुत अधिक आवर्धन और रिज़ॉल्यूशन प्राप्त होता है। यह सूक्ष्मजीवों, कोशिकाओं,बड़े अणुओं और धातुओं जैसी छोटी वस्तुओं को देखने के लिए इस्तेमाल किया जाता है।
पहला इलेक्ट्रॉन माइक्रोस्कोप 1931 में अर्न्स्ट रुस्का और मैक्स नोल द्वारा बनाया गया था, जो इस क्षेत्र में एक महत्वपूर्ण प्रगति को दर्शाता है।
कोशिका सिद्धांत:-इस सिद्धांत के अनुसार सभी पौधे तथा जंतु कोशिकाओं से बने हैं और यह जीवन की मूलभूत इकाई है।
कुछ जीवों में विभिन्न प्रकार की कोशिकाएं भी हो सकती हैं। यह मानव शरीर की कुछ कोशिकाएं हैं:-
1-रुधिर कोशिकाएं
2-तंत्रिका कोशिका
3-वसा कोशिका
4-शुक्राणु
5-अंडाणु
6-अस्थि कोशिका
7-चिकनी पेशी कोशिका
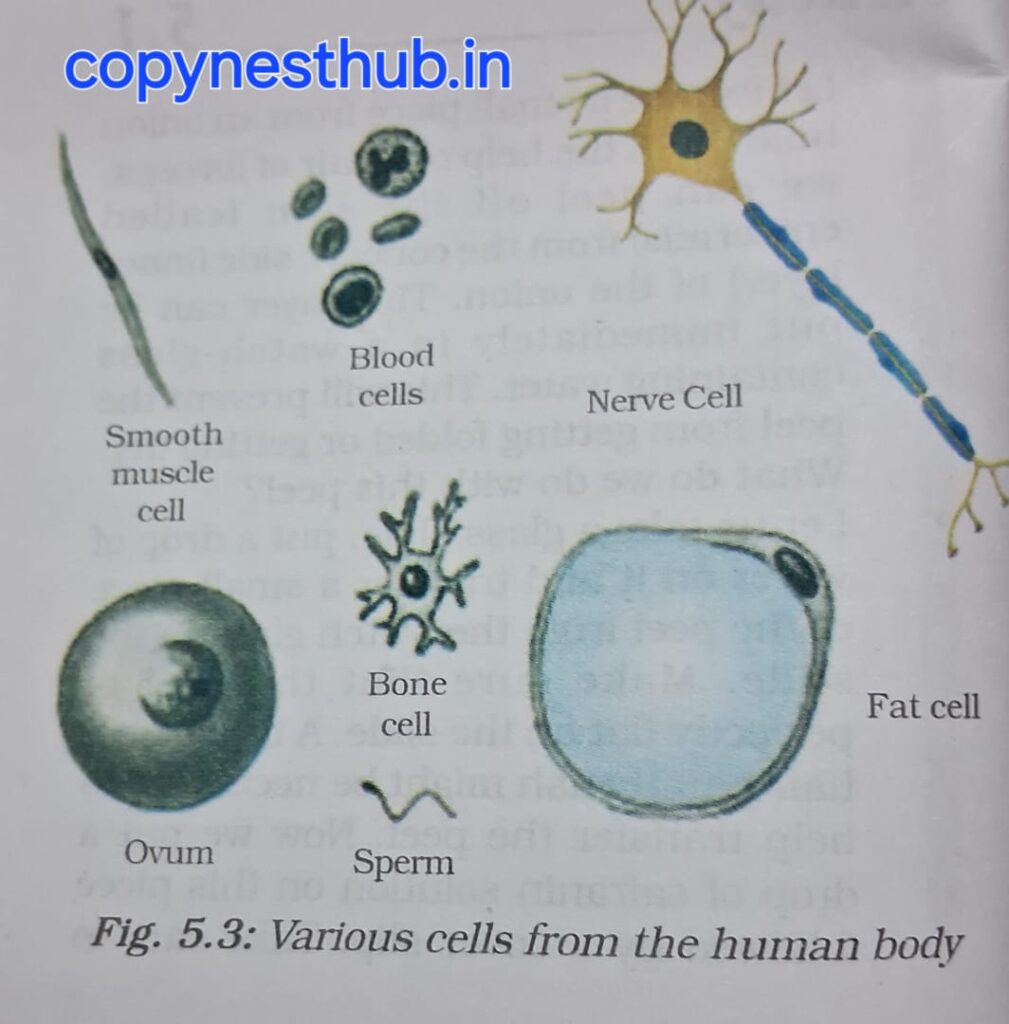
कोशिकाओं की आकृति तथा आकार उनके विशिष्ट कार्यों के अनुरूप होती है।
कुछ कोशिका अपना आकर बदलती रहती हैं। जैसे- अमीबा, मनुष्य के रुधिर में पाई जाने वाली श्वेत रक्त कणिकाएं(RBC- Red Blood Corpuscles)
कुछ कोशिका का आकार लगभग स्थिर रहता है। जैसे- तंत्रिका कोशिका।
प्रत्येक जीवित कोशिका में कुछ कार्य करने की क्षमता होती है, जो सभी सजीवों का एक गुण है।
बहुकोशिकीय जीवो में श्रम विभाजन होता है, जैसा कि मनुष्यों में। इसका अर्थ यह है कि शरीर के विभिन्न अंग विभिन्न कार्य करते हैं। जैसे- मनुष्य के शरीर में हृदय रुधिर को पंप करता है तथा आमाशय भोजन का पाचन इत्यादि करता है। इसी प्रकार एक कोशिकीय में भी श्रम विभाजन होता है। वास्तव में ऐसी प्रत्येक कोशिका में कुछ विशिष्ट घटक होते हैं, जिसे कोशिका अंगक( कोशिकांग) कहते हैं। प्रत्येक कोशिकांग एक विशिष्ट कार्य करता है। जैसे-कोशिका में एक नए पदार्थ का निर्माण, अपशिष्ट पदार्थ का निष्कासन इत्यादि। इन कोशिकांगों के कारण ही एक कोशिका जीवित रहती है और अपने सभी कार्य करती है। यह कोशिकांग मिलकर एक मूलभूत इकाई बनाते हैं, जिसे कोशिका कहते हैं।
NOTE:- सभी कोशिकाओं में एक ही प्रकार के कोशिकांग होते हैं। इससे कोई फर्क नहीं पड़ता कि उसके कार्य क्या है अथवा वह किस जीव में पाई जाती है।
TOPIC NO.2- कोशिका किससे बनी होती है? कोशिका का संरचनात्मक संगठन क्या है?
यदि हम कोशिका का अध्ययन सूक्ष्मदर्शी से करें तो हमें लगभग प्रत्येक कोशिकाओं में तीन गुण दिखाई देंगे:-
1-प्लाज्मा झिल्ली अथवा कोशिका झिल्ली या कोशिका कला (Plasma membrane or Cell membrane)
2-केंद्रक(Nucleus)
3-कोशिका द्रव(Cytoplasm)
कोशिका के अंदर होने वाले समस्त क्रियाकलाप तथा उसकी बाह्य पर्यावरण से पारस्परिक क्रियाएं इन्हीं गुणों के कारण संभव है।
(1)-प्लाज्मा झिल्ली अथवा कोशिका झिल्ली (Cell membrane):- इसे जीवद्रव कला भी कहा जाता है। यह रचना पौधे तथा जंतु दोनों में पायी जाती है। पादप कोशिका में कोशिका भित्ति के ठीक भीतर स्थित होती है। जंतु कोशिका में कोशिका का सबसे बाहरी आवरण होता है।
यह कोशिका की सबसे बाहरी परत है, जो कोशिका के घटकों को बाहरी पर्यावरण से अलग करती है।यह कुछ पदार्थ को अंदर अथवा बाहर आने जाने देती है।यह अन्य पदार्थों की गति को भी रोकती हैं।इसको वर्णनात्मक पारगम्य झिल्ली भी कहते हैं।
कोशिका कला की संरचना सन 1972 में सिंगर तथा निकोलसन द्वारा प्रस्तुत “तरल मोजेक मॉडल” के अनुसार मानी जाती है।
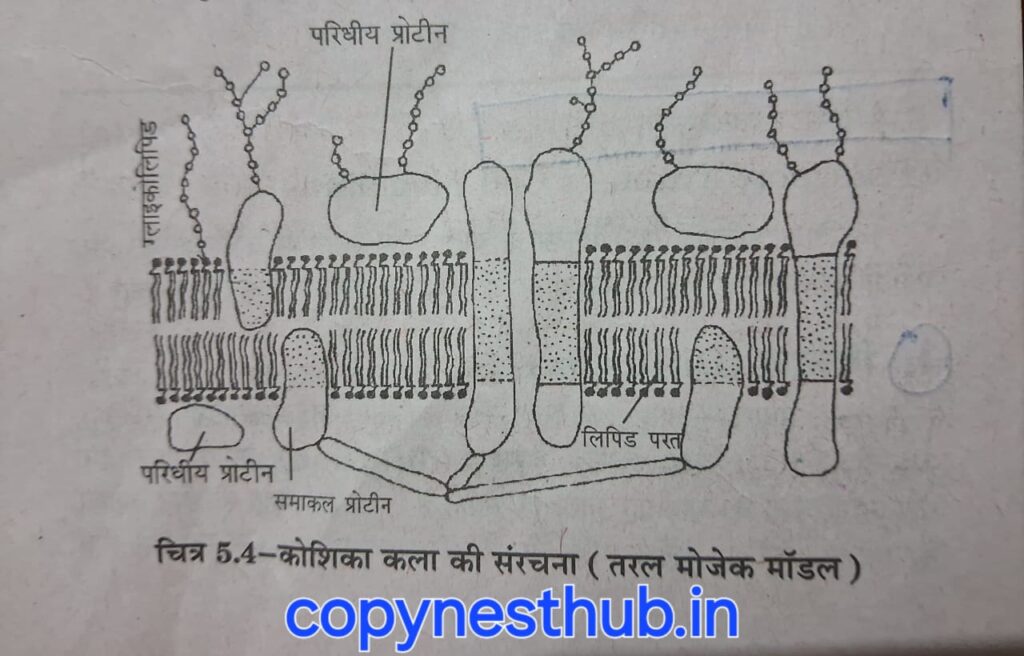
तरल मोज़ेक मॉडल:- कोशिका झिल्ली की संरचना का एक मॉडल है,जो इसे एक गतिशील, लचीली संरचना के रूप में वर्णित करता है जिसमें विभिन्न घटक होते हैं जो एक साथ तैरते हैं। यह मॉडल 1972 में सिंगर और निकोलसन द्वारा प्रस्तावित किया गया था।
तरल मोज़ेक मॉडल के अनुसार, कोशिका झिल्ली मुख्य रूप से फॉस्फोलिपिड्स की एक द्वि-परत से बनी होती है,जिसमें प्रोटीन अणु एम्बेडेड होते हैं। ये घटक एक साथ “तरल” की तरह गति करते हैं, जिसका अर्थ है कि वे झिल्ली के भीतर स्वतंत्र रूप से आगे-पीछे जा सकते हैं।
इंटीग्रल प्रोटीन, जिन्हें आंतरिक या झिल्ली प्रोटीन भी कहा जाता है, वे प्रोटीन होते हैं जो कोशिका झिल्ली के लिपिड बाइलेयर में स्थायी रूप से एम्बेडेड होते हैं। ये प्रोटीन झिल्ली के दोनों तरफ फैले हो सकते हैं, और कुछ तो पूरी झिल्ली को पार करते हैं, जिन्हें ट्रांसमेम्ब्रेन प्रोटीन कहा जाता है। टनल प्रोटीन, जिन्हें ट्रांसमेम्ब्रेन प्रोटीन भी कहा जाता है, इंटीग्रल प्रोटीन का एक प्रकार है जो कोशिका झिल्ली में सुरंग जैसा मार्ग बनाता है, जिससे कुछ अणु और आयन झिल्ली के आर-पार जा सकते हैं।
NOTE:- वर्णात्मक पारगम्य झिल्ली (Selectively permeable membrane) एक ऐसी झिल्ली होती है जो कुछ पदार्थों को अपने से होकर गुजरने देती है, जबकि अन्य पदार्थों को रोकती है। इसे अर्धपारगम्य झिल्ली (Semi-permeable membrane) भी कहा जाता है।
(1)-पारगम्य(permeable):- एक पारगम्य झिल्ली सभी पदार्थों, विलायकों और विलेय दोनों को,अपने से स्वतंत्र रूप से गुजरने देती है।
(2)-अर्धपारगम्य(Semipermeable):-अर्धपारगम्य झिल्ली केवल विलायक अणुओं (जैसे पानी) को ही गुजरने देती है, लेकिन विलेय अणुओं (जैसे नमक या चीनी) को नहीं।
(3)-अपारगम्य(Impermeable) :- अपारगम्य झिल्ली किसी भी पदार्थ को अपने से होकर गुजरने नहीं देती।
कोशिका कला के कार्य:-
1-यह विभिन्न पदार्थों कोशिका में प्रवेश तथा उनके बाहर निकलने की प्रक्रिया को नियंत्रित करता है।
2-यह बाहरी तरल एवं ठोस पदार्थ को चारों ओर से घेरकर कोशिका में रखती है, जहां इसका पाचन होता है। यह कोशिका से उत्सर्जी पदार्थ को बाहर निकलने का भी कार्य करती है।
3-यह कोशिका को निश्चित आकृति या रूप प्रदान करती है।
कोशिका कला द्वारा परिवहन:- कोशिका कला द्वारा कोशिका के बाहर वाले स्थान से कोशिका के अंदर पदार्थ का आगमन कुछ प्रक्रियाओं द्वारा संभव होता है:-
(1)-विसरण(Diffusion)
(2)-परासरण(Osmosis)
कुछ पदार्थ जैसे- कार्बन डाइऑक्साइड,ऑक्सीजन कोशिका झिल्ली के आर-पार विसरण प्रक्रिया द्वारा आ-जा सकते हैं।
(1)-विसरण(Diffusion):- एक ऐसी प्रक्रिया है जिसमें अणु,आयन या अन्य कण उच्च सांद्रता वाले क्षेत्र से निम्न सांद्रता वाले क्षेत्र की ओर गति करते हैं,जब तक कि सांद्रता समान न हो जाए।यह प्रक्रिया स्वतः होती है और इसे किसी बाहरी बल की आवश्यकता नहीं होती है।
उच्च सांद्रता के क्षेत्र से निम्न सांद्रता के क्षेत्र की ओर एक समान सांद्रता बनाने के लिए अणुओं की स्वतंत्र गति है। यह ठोस और द्रव की अपेक्षा गैसीय अवस्था में तीव्रता होता है।
कुछ पदार्थ जैसे कार्बन डाइऑक्साइड, ऑक्सीजन, जल इत्यादि विसरण नामक प्रक्रिया द्वारा प्लाज्मा झिल्ली के आर-पार गति कर सकते हैं।
NOTE:- पदार्थ की गति उच्च सांद्रता से निम्न सांद्रता की ओर होती है।
जब कार्बन डाइऑक्साइड जो एक कोशिकीय अपशिष्ट है,जिसका निष्कासन आवश्यक होता है। जब कार्बन डाइऑक्साइड कोशिका में एकत्र हो जाती है तो उसकी सांद्रता बढ़ जाती है। कोशिका के बाह्य पर्यावरण में कार्बन डाइऑक्साइड की सांद्रता कोशिका में स्थित कार्बन डाइऑक्साइड की सांद्रता की अपेक्षा कम होती है, जैसे ही कोशिका के अंदर और बाहर कार्बन डाइऑक्साइड की सांद्रता में अंतर आता है, इस समय उच्च सांद्रता से निम्न सांद्रता की ओर विसरण द्वारा कोशिका से कार्बन डाइऑक्साइड बाहर निकल जाती है।इसी प्रकार जब कोशिका में ऑक्सीजन की सांद्रता कम हो जाती है, तो ऑक्सीजन बाहर से कोशिका में विसरण द्वारा अंदर चली जाती है। अतः कोशिका तथा बाह्य पर्यावरण में गैसों के आदान-प्रदान में विसरण एक महत्वपूर्ण भूमिका निभाता है।

(2)- परासरण(Osmosis):- जल के अणुओं की गति जब वर्णनात्मक पारगम्य झिल्ली (जैसे- प्लाज्मा झिल्ली) द्वारा हो,तो उसे परासरण कहते हैं।
कोशिका की प्लाज्मा झिल्ली के आर-पार जल की गति जल में विलेय पदार्थ की मात्रा द्वारा प्रभावित होती है।
जल भी विसरण के नियमों के अनुकूल व्यवहार करता है।इस प्रकार परासरण में जल के अणु वर्णनात्मक पारगम्य झिल्ली द्वारा उच्च जल की सांद्रता से निम्न जल की सांद्रता की ओर जाते हैं।
यदि हम किसी जंतु कोशिका अथवा पादप कोशिका को शक्कर अथवा नमक के विलयन में रखें तो क्या होगा?
निम्नलिखित तीन घटनाओं में से घटना हो सकती है:-
WORK ON PROGRESS…